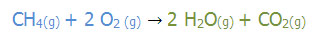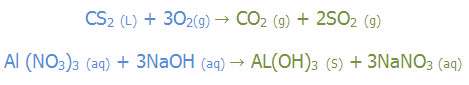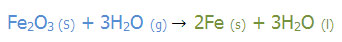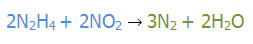|
chemistrynovin.loxblog.com chemistrynovin.loxblog.com درباره وبلاگ به وبلاگ من خوش آمدید آرشيو وبلاگ نويسندگان دو شنبه 23 بهمن 1398برچسب:, :: 15:5 :: نويسنده : امین الدین عزیزی
موازنه کردن معادله ی یک واکنش شیمیایی
در مقاله قبلی در مورد نماد شیمیایی و معادله ی شیمیایی واکنش ها توضیحاتی ارائه شد. در این مقاله به بررسی قانون پایستگی ماده یا جرم خواهیم پرداخت و نحوه ی موازنه کردن یک معادله ی شیمیایی ارائه خواهد شد...
در طی انجام واکنش های شیمیایی نه اتمی از بین نمی رود و نه اتمی ایجاد می شود. بلکه در حین انجام واکنش اتم های واکنش دهنده ها به شیوه ای دیگر به هم متصل می شوند.
(مشابه این قانون پیوستگی انرژِی نیز چنین عنوان می شود که انرژی از بین نمی رود و به وجود نمی آید، بلکه از صورتی به صورت دیگر تبدیل می شود.) در یک معادله ی شیمیایی، می بایستی تعداد اتم های عناصر در دو طرف معادله یکسان باشد.
به طور مثال اگر از اتم x در سمت واکنش دهنده ها 5 عدد وجود دارد، حتماً در طرف دیگر واکنش در بخش فراورده نیز از اتم x تعداد 5 عدد وجود داشته باشد.
مثال زیر، معادله ی واکنش شیمیایی سوختن گاز متان است:
به ترتیب برای تعداد هر اتم، در سمت راست و چپ واکنش (واکنش دهنده ها و فراورده ) باید بررسی شود. اتم کربن در هر دو طرف معادله یک عدد می باشد. با قرار دادن عدد 2 در پشت آب ( H2O) خواهیم دید که تعداد اتم های هیدورژن در هر دو طرف معادله برابر 4 اتم می باشد. تعداد اتم های اکسیژن در سمت راست 4 اتم می باشد پس با قرار دادن ضریب دو برای اکسیژن (O2)تعداد اتم های اکسیژن در دو طرف معادله 4 و برابر می باشد. به هنگام موازنه کردن این معادله ی شیمیایی، زیروند (اندیس) های موجود در فرمول شیمیایی واکنش دهنده ها و فرآورده ها تغییر نکرد، بلکه ضرایب غیر کسری مناسبی انتخاب و پیش از فرمول شیمیایی واکنش دهنده ها و فراورده ها قرار گرفت. این ضرایب طوری انتخاب می شوند که تعداد اتم های موجود در دو سوی معادله ی شیمیایی برابر باشد.
طبق قرارداد؛ضرایب نهایی موجود در یک معادله ی موازنه شده بایستی کوچک ترین عدد صحیح (غیر کسری) ممکن باشد. به مثال های زیر توجه کنید:
موازنه کردن به روش والسی رایج ترین روش برای موازنه کردن یک معادله شمیایی، روش وارسی نام دارد. در این روش ابتدا لازم است برای برابر کردن تعداد اتم های هر یک از عنصرها در دو سوی معادله، عنصر به عنصر مراحل انتخاب ضریب (برای یک واکنش دهنده ها یا فراورده دارای آن عنصر) صورت پذیرد و سپس اقدام به شمارش اتم ها در دو سوی معادله کرد.
برای موازنه کردن معادله ی شیمیایی واکنش به روش وارسی اقدامات زیر الزامی است:
انتخاب عنصر آغاز گر برای موازنه، حساس ترین مرحله در موازنه یک واکنش شیمیایی است.
این عنصر باید به ترتیب اولویت شرایط زیر را داشته باشد:
نکته: اگر در موازنه با ضریب کسری مواجه شدیم، کل طرفین را باید در کوچکترین مضرب مشترک کسرها ضرب کنیم تا ضریب های کسری از بین بروند.
به مثال های زیر توجه کنید:
عنصر آغازگر Fe است.
عنصر آغاز گر H است. یک شنبه 22 بهمن 1398برچسب:, :: 18:0 :: نويسنده : امین الدین عزیزی
چگونگی تشکیل پیوندهای کوالانسیدر واکنش بین فلزات و نافلزات، اتمهای فلزی به از دست دادن الکترون و اتمهای نافلزی به جذب الکترون گرایش دارند. در نتیجه، در این واکنشها، الکترونها از اتمی به اتم دیگر منتقل میشوند و ترکیبات یونی به وجود میآید.
وقتی اتمهای نافلزات بر هم اثر میکنند، انتقال الکترونی از اتمی به اتم دیگر رخ نمیدهد، زیرا توانایی جذب الکترون دو اتم، مشابه (و هرگاه هر دو اتم از یک عنصر باشند، یکسان) است. به این ترتیب به جای انتقال، الکترونها بین دو اتم قرار میگیرند و به اشتراک گذارده میشوند.
آنچه اتمهای یک مولکول را به هم نگه میدارد، پیوند کوالانسی است، که در آن دو اتم، در الکترونهای پیوندی، شریکند. پیوند یگانه کوالانسی، متشکل از یک جفت الکترون (دارای اسپین مخالف) است، که اوربیتالی از هر دو اتم پیوند شده را اشغال میکند.
برای مثال، پیوندی را که بین دو اتم هیدروژن تشکیل میشود در نظر بگیرید. هر اتم تنهای هیدروژن، تک الکترونی دارد که در یک اوربیتال
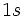 به طور متقارن دور هسته آن توزیع شده است. وقتی دو اتم هیدروژن یک پیوند کوالانسی تشکیل میدهند، دو اوربیتال اتمی به نحوی همپوشانی میکنند که ابرهای الکترونی، در ناحیه بین دو هسته، یکدیگر را تقویت میکنند و احتمال یافتن الکترون در این ناحیه افزایش مییابد. طبق اصل طرد پائولی دو الکترون این پیوند باید اسپین مخالف داشته باشند. استحکام پیوند کوالانسی ناشی از جاذبه متقابل دو هسته مثبت و ابر منفی الکترونهای پیوندی است. به طور متقارن دور هسته آن توزیع شده است. وقتی دو اتم هیدروژن یک پیوند کوالانسی تشکیل میدهند، دو اوربیتال اتمی به نحوی همپوشانی میکنند که ابرهای الکترونی، در ناحیه بین دو هسته، یکدیگر را تقویت میکنند و احتمال یافتن الکترون در این ناحیه افزایش مییابد. طبق اصل طرد پائولی دو الکترون این پیوند باید اسپین مخالف داشته باشند. استحکام پیوند کوالانسی ناشی از جاذبه متقابل دو هسته مثبت و ابر منفی الکترونهای پیوندی است. مولکول هیدروژن را میتوان با نماد
 یا یا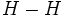 نشان داد. در ساختار اول، جفت الکترون مشترک با دو نقطه و در ساختار دوم با یک خط کوتاه نشان داده شده است. این جفت الکترون پیوندی متعلق به کل مولکول هیدروژن است، ولی میتوان تصور کرد که هر اتم هیدروژن، با دارا شدن دو الکترون (در تراز نشان داد. در ساختار اول، جفت الکترون مشترک با دو نقطه و در ساختار دوم با یک خط کوتاه نشان داده شده است. این جفت الکترون پیوندی متعلق به کل مولکول هیدروژن است، ولی میتوان تصور کرد که هر اتم هیدروژن، با دارا شدن دو الکترون (در تراز )، آرایش الکترونی پایدار گاز نجیب هلیم را پیدا کرده است. به عبارت دیگر، الکترونهای پیوندی دو بار به حساب میآیند، برای هر یک از اتمهای پیونددار شده یکبار. )، آرایش الکترونی پایدار گاز نجیب هلیم را پیدا کرده است. به عبارت دیگر، الکترونهای پیوندی دو بار به حساب میآیند، برای هر یک از اتمهای پیونددار شده یکبار.فرمول هیدروژن،
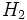 ، نماینده یک واحد مستقل و مجزا موسوم به مولکول است و گاز هیدروژن متشکل از مجموعهای از این مولکولهاست. در ترکیبات کاملاً یونی، مولکول وجود ندارد. فرمول سدیم کلریداست که نشاندهنده سادهترین نسبت کاتیونهای سدیم و آنیونهای کلرید در بلور سدیم کلرید است (نسبت 1 به 1). فرمولهایی از قبیل ، نماینده یک واحد مستقل و مجزا موسوم به مولکول است و گاز هیدروژن متشکل از مجموعهای از این مولکولهاست. در ترکیبات کاملاً یونی، مولکول وجود ندارد. فرمول سدیم کلریداست که نشاندهنده سادهترین نسبت کاتیونهای سدیم و آنیونهای کلرید در بلور سدیم کلرید است (نسبت 1 به 1). فرمولهایی از قبیل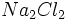 یا یا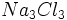 ، نادرستند، زیرا چنین واحدهای مستقل و مجزایی (چنین مولکولهایی) در بلور سدیم کلرید وجود ندارند و این فرمولها سادهترین نسبت یونی را نیز بیان نمیکنند. اما برای مواد کوالانسی فرمولهایی مثل ، نادرستند، زیرا چنین واحدهای مستقل و مجزایی (چنین مولکولهایی) در بلور سدیم کلرید وجود ندارند و این فرمولها سادهترین نسبت یونی را نیز بیان نمیکنند. اما برای مواد کوالانسی فرمولهایی مثل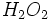 میتواند درست باشد. این فرمول نشانه واحدی مستقل و مجزا (مولکول) است که دو اتم هیدروژن و دو اتم اکسیژن دارد. میتواند درست باشد. این فرمول نشانه واحدی مستقل و مجزا (مولکول) است که دو اتم هیدروژن و دو اتم اکسیژن دارد.ساختار مولکولها را، اغلب میتوان با استفاده از نماد عناصر به همراه نقطههایی که نماینده الکترونهای والانس هستند، نشان داد. این فرمولهای الکترون- نقطهای را ساختار والانس پیوندی یا ساختار لوئیس مینامند.
 این نامگذاری به افتخار گیلبرت. ن. لوئیس، که این نظریه پیوند کوالانسی را در سال 1916 مطرح کرد انجام گرفته است. نظریه لوئیس تأکید میکند که اتمها برای رسیدن به آرایش الکترونی گازهای نجیب، پیوند کوالانسی تشکیل داده، مولکولها را بوجود میآورند. برای بیشتر اتمها معنی این گفته رسیدن به آرایش هشتایی است، ولی برای هیدروژن آرایش دو الکترونی هلیم پایدار است.
مولکول، هیدروژن دو اتمی است. برخی عناصر دیگر نیز به صورت مولکول دو اتمی وجود دارند. هر اتم هالوژن (عنصر گروه
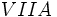 ) هفت الکترون والانس دارد. با تشکیل یک پیوند ساده کوالانسی بین دو تا از این اتمها، هر اتم به آرایش الکترونی هشتایی، که ویژه گازهای نجیب است، میرسد. مثلاً در مورد فلوئور، ) هفت الکترون والانس دارد. با تشکیل یک پیوند ساده کوالانسی بین دو تا از این اتمها، هر اتم به آرایش الکترونی هشتایی، که ویژه گازهای نجیب است، میرسد. مثلاً در مورد فلوئور، تنها یک جفت الکترونی که بین دو اتم قرار گرفته است در دو اتم مشترک است و پیوند کوالانسی را تشکیل میدهد. توجه کنید که در محاسبه هشتایی هر اتم، الکترونهای پیوندی دوبار به حساب میآیند، برای هر اتم یکبار.
اغلب میتوان تعداد پیوندهای جفت الکترونی را که یک اتم در یک مولکول بوجود میآورد از تعداد الکترونهای مورد نیاز برای پر شدن پوسته والانس آن اتم، پیشبینی کرد. چون برای نافلزات، شماره گروه در جدول با تعداد الکترونهای والانس برابر است، میتوان پیشبینی کرد که عناصر گروه
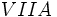 مثل مثل 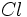 (با هفت الکترون والانس)، برای رسیدن به هشتایی پایدار یک پیوند کوالانسی؛ عناصر (با هفت الکترون والانس)، برای رسیدن به هشتایی پایدار یک پیوند کوالانسی؛ عناصر 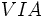 مثل مثل  و و 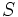 (با شش الکترون والانس) دو پیوند کوالانسی، عناصر (با شش الکترون والانس) دو پیوند کوالانسی، عناصر 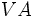 مثل مثل 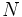 و و 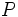 (با پنج الکترون والانس) سه پیوند کوالانسی و عناصر (با پنج الکترون والانس) سه پیوند کوالانسی و عناصر 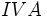 مثل مثل 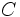 (با چهار الکترون والانس) چهار پیوند کوالانسی بوجود خواهند آورد. ترکیبات هیدروژندار زیر را در نظر بگیرید: (با چهار الکترون والانس) چهار پیوند کوالانسی بوجود خواهند آورد. ترکیبات هیدروژندار زیر را در نظر بگیرید:  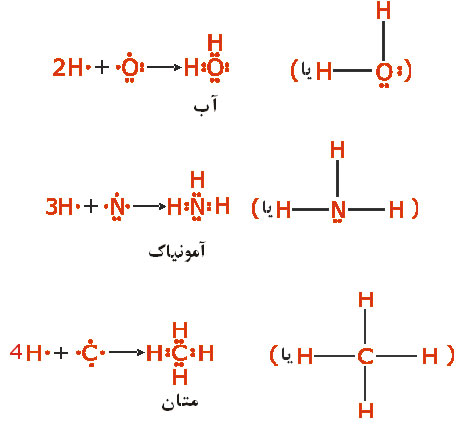 دقت کنید که در این مولکولها، هر اتم هیدروژن را میتوان دارای پوسته
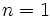 کامل و بقیه اتمها را دارای ساختار هشتایی گاز نجیب دانست. کامل و بقیه اتمها را دارای ساختار هشتایی گاز نجیب دانست.بررسی پیوند کوالانسی از دیدگاه مکانیک موجیبررسی جزئیات ماهیت پیوند کوالانسی اتم کار مشکلی است. از این رو، همواره توصیف ساده و مفیدی از آن مورد نظر میباشد. این توصیف ساده، از دیدگاه مکانیک موجی همان همپوشانی اوربیتالهای اتمی است که اساس تشکیل و معیار قدرت پیوند کوالانسی محسوب میشود. همپوشانی اوربیتالهای (در هم رفتن ابر الکترونی) دو اتم که ضمن نزدیک شدن آنها صورت میگیرد، موجب میشود تا دانسیته الکترونی در فضای بین هسته دو اتم افزایش یابد. این عمل میزان نیروهای جاذبه الکتریکی سیستم (نیروهای جاذبه بین هسته یک اتم و الکترونهای اتم دیگر) را افزایش داده و آن را بر نیروهای دافعه الکتریکی سیستم (نیروهای دافعه بین هستهها و نیروهای دافعه بین الکترونهای لایه ظرفیت دو اتم) غلبه میدهد. در نتیجه، جاذبهای بین دو اتم بوجود میآید که آنها را به یکدیگر اتصال میدهد. به بیانی دیگر، بین آنها پیوند کوالانسی برقرار میشود.
اولین نظریه در مورد بررسی چگونگی تشکیل پیوند کوالانسی بین دو اتم، براساس مدل موجی اتم، در سال 1927 توسط هایتلر و لاندن، در مورد پیوند در مولکول هیدروژن ارائه شد که به صورت زیربنای مفیدی برای بحث و بررسی در مورد پیوند در مولکولهای دیگر مورد استفاده قرار گرفت.
نظریه پیوند ظرفیت (V . B . T)این نظریه به منظور بسط و تعمیم نظریه هایتلر- لاندن و نیز توجیه خصلت جهتدار بودن پیوندهای کوالانسی، توسط پائولینگ و اسلیتر در سال 1931 ارائه شد و بر پایه دو فرض اساسی، یعنی، حالت والانس (حالت برانگیخته) اتم و هیبریداسیون اوربیتالهای لایه ظرفیت اتم مرکزی استوار است و اهمیت آن در پیشگویی شکل هندسی مولکولها و یونها است.
براساس این نظریه، ترکیبات پایدار، از پرشدن تمام اوربیتالهای پیوندی یا غیرپیوندی لایه ظرفیت اتمها حاصل میشوند و یک ترکیب موقعی بالاترین پایداری خود را بدست میآورد که اتم مرکزی آن به بالاترین عدد کوئوردیناسیون (بالاترین تعداد پیوند کوالانسی) خود برسد. شکل مولکول یا یون عمدتاً با توجه به خصلت جهتدار بودن اوربیتالهای اتمی قابل پیشگویی است. هر پیوند کوالانسی را بر اثر همپوشانی دو اوربیتال اتمی و تشکیل اوربیتال مولکولی پیوندی که دو الکترون پیوندی براساس اصل طرد پائولی با اسپینهای ناهمسو در آن قرار میگیرند (تا دافعه بین آنها به حداقل برسد)، بین دو اتم برقرار میشود. اوربیتالهای مولکولی، از نظر عدد کوآنتومی، مفهوم فیزیکی تابع موج، احتمال و غیره، تفاوت اساسی با اوربیتالهای اتمی تشکیلدهنده خود ندارند و انرژی آنها برابر مجموع انرژی الکترونهای پیوندی است. مهمترین تفاوت اوربیتالهای اتمی و مولکولی در این است که گسترش طولی اوربیتالهای مولکولی بیشتر است و الکترونها در آن تحت جاذبه هر دو هسته قرار دارد.
یک شنبه 22 بهمن 1398برچسب:, :: 17:49 :: نويسنده : امین الدین عزیزی
قانون بقاي جرم لاوازيهمقدمه  آزمايش هاي آنتوان لاوازيه، شروع يک انقلاب در علم شيمي است. اين آزمايش ها را مي توان سرآغاز علم شيمي جديد دانست. او با توجه به نتايج آزمايش هاي کمي به توضيح پديده هاي شيميايي دست يافت و نظريه فلوژيستون را در توجيه فرايندهاي شيميايي برانداخت.
قانون بقاي جرم قانون بقاي جرم مي گويد که در جريان يک واکنش شيميايي تغييري در جرم ، که قابل تشخيص باشد روي نمي دهد. تا قبل از قرن هجدهم ميلادي اصل بقاي جرم و اصل بقاي انرژي، دو اصل کلي و مستقل بودند که پايه هاي دانش را تشکيل مي دادند. در نيمه دوم قرن هجدهم ميلادي لاوازيه دانشمند فرانسوي پس از يك سلسله تجربيات دريافت كه مقدار جرم ماده كه در فعل و انفعالات شيميايي دخالت دارند همواره ثابت مي ماند و اين مشخصه مواد رادر قانون زير به نام قانون بقاي جرم خلاصه نمود.
در محدوده فيزيک کلاسيک؛ در دستگاه هاي منزوي هيچ جرمي از بين نمي رود و هيچ جرمي نيز به خودي خود و بدون جرم ديگر به وجود نمي آيد و يا به عبارت ديگر مقدار جرم مادي كه در عالم وجود دارد همواره ثابت است. اصل بقاي انرژي مي گويد انرژي هر دستگاه معين مقدار ثابتي دارد. نه مي توان انرژي را خلق كرد و نه آن را از بين برد فقط انرژي از شکلي به شکل ديگر تغيير مي کند . با وجود تغييراتي كه ممكن است در ديگر كميت هاي دستگاه (مثل انرژي ،حجم ودما ) رخ دهد، جرم كل دستگاه به شرط منزوي بودن ثابت خواهد بود. يعني اين كه جرم نمي تواند آفريده شود و يا از بين برود، يا توليد و يا نابود شود. به عبارت ديگر مي توان گفت كه جرم خاصيت زوال ناپذير ماده است كه در تغييرات شيميايي ماده همواره ثابت مي ماند. تنها از ماده اي به ماده ديگر منتقل مي شود به طور كلي در هيچ تغييري جرم ماده از بين نمي رود و يا به وجود نمي آيد. به طوري كه جرم كل جهان همواره ثابت مي ماند.  البته سيستم هايي وجود دارند كه جرم آن ها درطول زمان تغيير مي كند. به عنوان مثال اگر حركت موشك را در نظر بگيريم. موشك قبل از پرتاب داراي يك مقدار جرم كل خواهد بود . اما بعد از پرتاب سوخت موشك مصرف مي شود بنابراين جرم سيستم موشك در اين لحظه با جرم آن قبل از پرتاب متفاوت خواهد بود. پس سيستم بقا نخواهد داشت. با اين حال اگر موشك و گازهاي خارج شده از آن را كلا به صورت يك سيستم فرض كنيم در اين صورت نيروهايي كه گازها ي خارج شده و موشك به يكديگر وارد مي كنند، در حكم نيروهاي داخلي بوده و شرط منزوي بودن سيستم برقرار مي شود و باز جرم بقا خواهد داشت. درحالتي كه سرعت جسم نزديك به سرعت نورباشد، دراين صورت ديگر در قلمرو فيزيك كلاسيك نخواهيم بود و لذا قانون بقاي جرم نقض مي شود . قانون بقاي جرم - انرژي: گفتيم كه اگر سرعت جسمي بتواند نزديك به سرعت نور برسد، در اين صورت از محدوده فيزيك كلاسيك خارج خواهيم شد. در اين حالت قوانين بقاي جرم وانرژي نقض مي شود، ودر عوض يك قانون واحد به نام قانون بقاي جرم- انرژي بيان مي شود. براين اساس هرگاه تغييري در مقدار جرم صورت گيرد، اين تغيير به وسيله تغيير انرژي جبران مي شود. به عنوان مثال اگر جرم كاهش يابد، در اين صورت به اندازه تغيير جرم انرژي توليد مي شود و برعكس، اگرجرم افزايش يابد، مقداري انرژي به جرم تبديل شده است. هم ارزي بين جرم و انرژي اولين بار توسط اينشتن در نظريه نسبيت بيان شد. در مورد تبديلات هسته اي نيز هم ارزي بين جرم وانرژي حاکم است.  لاوازيه اعلام کرد که تغييرات انرژي در واکنش هاي شيميايي معمولي ممکن است در نتيجه تغيير جرم باشد ولي اين گونه تغييرات جرمي بسيار کمتر از آن است که از طريق آزمايش قابل تشخيص باشد ازاين رو قانون بقاي جرم همان طوري که بيان شد ، براي تمام واکنش ها معتبر است به استثناء واکنش هايي که با تغييرات هسته اي همراه باشند . اين قانون نخستين بار توسط آنتوان لاوازيه در اثري از او با عنوان بررسي مقدماتي شيمي 1 رسماً بيان شده است ولي کساني هم که پيش از او با روش هاي کمي سروکار داشته اند چنين اصلي را پذيرفته بودند قانون بقاي جرم تا آنجا که به معادلات شيميايي مربوط مي شود به اين معني است که اتم هاي هر عنصر خواه ترکيب شده وخواه ترکيب نشده به همان تعداد که در طرف چپ معادله ديده مي شوند در طرف راست آن هم بايد وجود داشته باشند.پنج شنبه 26 بهمن 1391برچسب:, :: 16:35 :: نويسنده : امین الدین عزیزی
علوم دوم - بخش اول
مواد در حال تغيير
به آن دسته از خواص گفته مي شود كه مشاهده و اندازه گيري آنها به توليد ماده جديد منجر نمي شود.
به مجموعه خواصي گفته مي شود كه تمايل يا عدم تمايل يك ماده به شركت در واكنش هاي شيميايي را بيان مي كند. مثلا اشتعال پذيري خاصه بنزين و عدم اشتعال پذيري خاصه آب است.
برخي از نشانه هاي تغيير شيميايي عبارتند از : الف) ظهور يك رنگ جديد مانند:
رنگ آبي مايل به سياه ‹------------- افزودن محلول يد به سيب زميني
شيري رنگ ‹--------------- دميدن در آب آهك
مانند حل شدن كلسيم كلريد در آب
توجه: هميشه واكنش دهنده در سمت چپ واكنش و فراورده در طرف راست واكنش قرار دارد.
با نور و گرماي شديد همراه است مانند سوختن منيزيم و يا احتراق مواد منفجره
نور و گرماي محسوس ندارد. مانند اكسيد شدن غذا در سلول هاي بدن- زنگ زدن آهن ط
يكي از اين شرايط را حذف مي كنند اين روشها عبارتنداز : الف) دور كردن مواد سوختني از اطراف آتش (حذف سوخت) مثل بستن شير گاز
آب از هيدروژن و اكسيژن تشكيل شده است . اين دو گاز در دماي معمولي هرگز با هم تركيب نمي شوند اما اگر مخلوط اين دو گاز را تا حدود 700 درجه سانتيگراد حرارت دهيم بسرعت با هم تركيب مي شوند و آب پديد مي آيد. با افزايش غلظت برخورد مؤثر بين مولكول هاي واكنش دهنده بيشتر و واكنش سريعتر مي شود نمودار مقابل رابطه غلظت با سرعت را نشان مي دهد.
موادي هستند كه سرعت واكنش هاي شيميايي را افزايش مي دهند اما خود دچار تغيير شيميايي نمي شوند و در پايان واكنش دست نخورده باقي مي مانند مثلا هيدروژن پراكسيد (آب اكسيژنه) در گرما و نور به آب و گاز اكسيژن تجزيه مي شود افزودن زنگ آهن سرعت تجزيه شدن را افزايش مي دهد. اگر مقداري گرد دي اكسيد منگنز به آب اكسيژنه اضافه كنيم سرعت واكنش بحدي افزايش مي يابد كه شروع به جوشيدن مي كند و گرماي قابل ملاحظه اي ازاد مي شود.(واكنش گرماده)
با افزايش سطح تماس سرعت واكنش زياد تر مي شود به همين علت است كه خاك اره سريعتر از تنه درخت مي سوزد و يا خوب جويدن غذا هضم آن را آسانتر مي كند. فعاليت:
تذكر: اين آزمايش را با احتياط و زير نظر بزرگتر ها انجام دهيد. مثلا از سوختن چوب در هوا، موادي مانند كربن، دود، خاكستر، بخار آب و ... پديد مي آيد جرم كربن، دود ، خاكستر ، بخار آب و هواي مصرف شده برابر جرم چوب اوليه خواهد بود.
پنج شنبه 26 بهمن 1391برچسب:, :: 14:41 :: نويسنده : امین الدین عزیزی
چهار شنبه 25 بهمن 1391برچسب:, :: 23:28 :: نويسنده : امین الدین عزیزی
کاربرد عدد آووگادروچون وزن اتمي فلوئور 19.0 و وزن اتمي هيدروژن 1.0 است، سنگيني يك اتم فلوئور 19 برابر يك اتم هيدروژن خواهد بود. حال اگر 100 اتم فلوئور و 100 اتم هيدروژن را در نظر بگيريم، جرم مجموع اتمهاي فلوئور 19 برابر جرم اتمهاي هيدروژن ميشود. پس جرمهاي هر دو نمونهاي از فلوئور و هيدروژن كه عمده اتمهاي آنها برابر باشد همان نسبت 19.0 به 1.0 يعني نسبت وزنهاي اتمي آنها ، خواهد بود. اگر 19.0g فلوئور و 1.0g هيدروژن داشته باشيم. اين دو مقدار بر حسب گرم و از لحاظ عددي برابر وزنهاي اتمي اين دو عنصر است. چون جرمهاي اين دو نمونه نسبت 19.0 به 1.0 دارد، نمونهها بايد شامل تعداد اتمهاي مساوي باشند. در واقع ، نمونهاي از هر عنصر كه جرم آن بر حسب گرم عددي برابر با وزن اتمي آن عنصر باشد، شامل اين عده اتمهاي يكسان خواهد بود. اين عدد را به افتخار آمدو آووگادرو عدد آووگادرو مينامند. آووگادرو نخستين كسي بود كه رفتار گازها در واكنش شيميايي را بر حسب عده مولكولها واكنش دهنده ، توضيح داد. مقدار عدد آووگادرو با آزمايش معين شده و تا شش رقم با معني عبارت است از:6.02205x10**23 تعريف مول مقدار خالصي كه شامل عدد آووگادرو واحد اصلي باشد يك مول ناميده ميشود كه يك واحد اصلي است. تعريف مول مقدار ماده خالصي است كه تعداد واحدهاي مستقل اصلي آن دقيقا برابر با تعداد اتمهاي 12g كربن 126C باشد. پس نمونهاي از يك عنصر كه جرم آن بر حسب گرم از لحاظ عددي برابر با وزن اتمي آن عنصر باشد، شامل يك مول از اتمهاي آن عنصر ، يعني شامل عدد آووگادرو اتم است. مثلا وزن اتمي بريليم 9.01218 است. بنابر اين : اتم بريليم Be=1mol Be = 6.02205x10**23 9.01218 مول ماده مولكولي يك مول مركب از عدد آووگادرو واحد مستقل است. يك مول ماده مولكولي مركب از عدد آدوگادرو مولكول و جرمي بر حسب گرم دارد كه از لحاظ عددي برابر با وزن مولكولي آن ماده است. مثلا وزن مولكولي H2O برابر 18.02 گرم است، پس مولكول H2O با 18.02g H2O =1MolH2O =6.02205x10**23 مولكول آب H2O . چون يك مولكول آب دو اتم H و يك اتم O دارد، يك مول H2O شامل دو اتم H و يك مول اتم O است. با استفاده از تعريف مول، نوع واحد مستقلي كه اندازه گيري ميشود بايد مشخص باشد. يك مول از اتم هاي H شامل 6.02205x10**23 اتم H و جرم آن ، تا سه رقم با معني ، 1.01g است، يك مول از مولكولهاي H2 شامل 6.02205x10**23 مولكول H2 و جرم آن 2.02g است. براي فلوئور : فلوئو گرم Mol F=6.02205x10**23 F=19.0 مولكول فلووئور 1Mol F2=6.02205x10**23 F2=38.0g مول در مواد يوني وقتي مي گوييم يك مول(BaCl2) به اين معني است كه نمونه مورد نظر ما شامل عدد آووگادرو واحد فرمولي است كه واحد مستقل آن مشخص است. يك مول BaCl2 جرمي برابر 208.3g دارد كه همان وزن فرمولي BaCl2 است. در واقع ، يك مول BaCl2 شامل ، باريم 137.3g= يون 1Mol Ba2=6.02205x10**23Ba2 كلر: 71.0g= يون 2Mol Cl2=6.02205x10**23BaCl2 كه روي هم ميشود : 208.3g Bacl2= واحد 1Mol BaCl2=6.02205x10 **23Cl2 (** به معني به توان مي باشد. 10 به توان 23 ) خوب است بدانيد: در سال 1811 آمادئو آووگادرو، قانون تركيب حجمي را توضيح داد. اصل آووگادرو ميگويد: حجمهاي مساوي همهي گازها در دما و فشار يكسان، داراي تعداد مولكولهاي برابر هستند. به عكس، تعداد مولكولهاي برابر از هر دو گاز، تحت شرايط دما و فشار يكسان، حجمهاي برابر را اشغال ميكنند. يك مول از يك ماده داراي 23**10*022/6 ذره است. بنابراين در شرايط دما و فشار يكسان، يك مول از يك گاز حجمي برابر با يك مول از هر گاز ديگر اشغال ميكند. در شرايط متعارفي اين حجم، به حجم مولي گاز در شرايط متعارفي موسوم است و برابر با 414/22 ليتر ميباشد. - تعداد واحدها در يك مول به افتخار آمادئو آووگادرو ، عدد آووگادرو ناميده ميشود . وي نخستين كسي بود كه رفتار گازها را برحسب تعداد مولكولهاي واكنش دهنده توجيه كرد . درواقع آقاي آووگادرو خودش مقدار عددي اين عدد را نتوانست به دست آورد، اما چون وي رفتار گازها را بر حسب تعداد مولكولهاي واكنش دهنده را مورد بررسي قرار داد، بعدها كه اين عدد بدست آمد، به افتخار آووگادرو كه بنيان گذار اين كار بود، به نام وي نام گذاري نمودند. مقدار اين عدد با روشهاي الكترو شيميايي و بلور شناسي معين شده است . در روش بلور شناسي مثلا يك عنصر را در نظر ميگيرند سپس با دستگاههاي دقيق ساختار عنصر و طول هريك از اضلاع سلول واحد بلور و وزن اتمي عنصر و وزن حجمي آن را مشخص ميكنند . سپس به كمك يك عمليات رياضي ميتوان به عدد آووگادرو دست يافت به عنوان مثال نيكل در سيستم مكعبي با وجوه مركز پر متبلور ميشود . طول هر يك از اضلاع سلول واحد 52/3 آنگسترم ، وزن اتمي نيكل 7/58 و وزن حجمي آن 94/8 است .حال به كمك اين دادهها عدد آووگادرو را حساب ميكنيم : هر سلول واحد داراي چهار اتم نيكل است . اگر عدد آووگادرو را N در نظر بگيريم ، وزن هر اتم برابر( 7 /58 تقسيم بر N) گرم خواهد بود . وزن هر سلول واحد چهار برابر اين مقدار و حجم آن برابر( 52/3 ضرب در ده به توان منفي هشت ) كل اين مقدار به توان سه ، سانتيمتر مكعب است . حال اكر اين دو را تقسيم كنيم چگالي نيكل بدست ميآيد كه البته ضريبي است از Nبا توجه به اينكه ميدانيم چگالي نيكل برابر است با 94/8 پس با ميتوانيم مقدار N را كه همان عدد آووگادرو است حساب كرد . اگر بخواهيم از روش الكترو شيمي استفاده كنيم بايستي عدد فاراده را تقسيم بر بار يك الكترون تنها كنيم كه در اين صورت مقدار عدد آووگادرو حساب ميشود . كاربرد عدد آووگادرو براي بيان مفهوم اتم گرم شيميدانها جرم يك مول يا 6.023*10**23اتم را اتم گرم ميگويند و آنرا برحسب گرم بيان ميكنند. براي مثال اتم اكسيژن ، 16 گرم و اتم كربن ، 12 گرم است؛ يعني جرم يك مول از اتمهاي اكسيژن كه شامل 6.023*10**23اتم است، برابر 16 گرم و به همين ترتيب ، جرم يك مول از اتمهاي كربن برابر 12 گرم است. مفهوم مولكول گرم بديهي است جرم يك مول از مولكولهاي يك ماده كه «مولكول گرم» ناميده ميشود. به كمك اتم گرم اتمهاي سازنده آن به آساني قابل محاسبه است. براي مثال ، مولكول گرم اكسيژن O2 برابر مجموع دو اتم اكسيژن 16+16=32گرم و مولكول گرم CO2برابر است با مجموع دو اتم اكسيژن و يك اتم كربن 44=16+16+12 گرم است. مفهوم جرم مولكولي شمار اجزاي يك مول برابر با عدد آووگادرو است. تعداد مولكولهاي موجود در يك مول از يك تركيب مولكولي ، برابر با عدد آووگادرو است و جرم آن بر حسب گرم برابر با وزن مولكولي آن تركيب است. براي مثال ، وزن مولكولي H2Oبرابر با 18.02 است. در نتيجه داريم: 1mol H2O= 6.023*10**23 H2O مولكول چون يك مولكول آب داراي يك اتم O است يك مولكول H2Oشامل دو اتم از اتم H و يك مولكول از اتم O است کاربرد عدد آووگادروچون وزن اتمي فلوئور 19.0 و وزن اتمي هيدروژن 1.0 است، سنگيني يك اتم فلوئور 19 برابر يك اتم هيدروژن خواهد بود. حال اگر 100 اتم فلوئور و 100 اتم هيدروژن را در نظر بگيريم، جرم مجموع اتمهاي فلوئور 19 برابر جرم اتمهاي هيدروژن ميشود. پس جرمهاي هر دو نمونهاي از فلوئور و هيدروژن كه عمده اتمهاي آنها برابر باشد همان نسبت 19.0 به 1.0 يعني نسبت وزنهاي اتمي آنها ، خواهد بود. اگر 19.0g فلوئور و 1.0g هيدروژن داشته باشيم. اين دو مقدار بر حسب گرم و از لحاظ عددي برابر وزنهاي اتمي اين دو عنصر است. چون جرمهاي اين دو نمونه نسبت 19.0 به 1.0 دارد، نمونهها بايد شامل تعداد اتمهاي مساوي باشند. در واقع ، نمونهاي از هر عنصر كه جرم آن بر حسب گرم عددي برابر با وزن اتمي آن عنصر باشد، شامل اين عده اتمهاي يكسان خواهد بود. اين عدد را به افتخار آمدو آووگادرو عدد آووگادرو مينامند. آووگادرو نخستين كسي بود كه رفتار گازها در واكنش شيميايي را بر حسب عده مولكولها واكنش دهنده ، توضيح داد. مقدار عدد آووگادرو با آزمايش معين شده و تا شش رقم با معني عبارت است از:6.02205x10**23 تعريف مول مقدار خالصي كه شامل عدد آووگادرو واحد اصلي باشد يك مول ناميده ميشود كه يك واحد اصلي است. تعريف مول مقدار ماده خالصي است كه تعداد واحدهاي مستقل اصلي آن دقيقا برابر با تعداد اتمهاي 12g كربن 126C باشد. پس نمونهاي از يك عنصر كه جرم آن بر حسب گرم از لحاظ عددي برابر با وزن اتمي آن عنصر باشد، شامل يك مول از اتمهاي آن عنصر ، يعني شامل عدد آووگادرو اتم است. مثلا وزن اتمي بريليم 9.01218 است. بنابر اين : اتم بريليم Be=1mol Be = 6.02205x10**23 9.01218 مول ماده مولكولي يك مول مركب از عدد آووگادرو واحد مستقل است. يك مول ماده مولكولي مركب از عدد آدوگادرو مولكول و جرمي بر حسب گرم دارد كه از لحاظ عددي برابر با وزن مولكولي آن ماده است. مثلا وزن مولكولي H2O برابر 18.02 گرم است، پس مولكول H2O با 18.02g H2O =1MolH2O =6.02205x10**23 مولكول آب H2O . چون يك مولكول آب دو اتم H و يك اتم O دارد، يك مول H2O شامل دو اتم H و يك مول اتم O است. با استفاده از تعريف مول، نوع واحد مستقلي كه اندازه گيري ميشود بايد مشخص باشد. يك مول از اتم هاي H شامل 6.02205x10**23 اتم H و جرم آن ، تا سه رقم با معني ، 1.01g است، يك مول از مولكولهاي H2 شامل 6.02205x10**23 مولكول H2 و جرم آن 2.02g است. براي فلوئور : فلوئو گرم Mol F=6.02205x10**23 F=19.0 مولكول فلووئور 1Mol F2=6.02205x10**23 F2=38.0g مول در مواد يوني وقتي مي گوييم يك مول(BaCl2) به اين معني است كه نمونه مورد نظر ما شامل عدد آووگادرو واحد فرمولي است كه واحد مستقل آن مشخص است. يك مول BaCl2 جرمي برابر 208.3g دارد كه همان وزن فرمولي BaCl2 است. در واقع ، يك مول BaCl2 شامل ، باريم 137.3g= يون 1Mol Ba2=6.02205x10**23Ba2 كلر: 71.0g= يون 2Mol Cl2=6.02205x10**23BaCl2 كه روي هم ميشود : 208.3g Bacl2= واحد 1Mol BaCl2=6.02205x10 **23Cl2 (** به معني به توان مي باشد. 10 به توان 23 ) خوب است بدانيد: در سال 1811 آمادئو آووگادرو، قانون تركيب حجمي را توضيح داد. اصل آووگادرو ميگويد: حجمهاي مساوي همهي گازها در دما و فشار يكسان، داراي تعداد مولكولهاي برابر هستند. به عكس، تعداد مولكولهاي برابر از هر دو گاز، تحت شرايط دما و فشار يكسان، حجمهاي برابر را اشغال ميكنند. يك مول از يك ماده داراي 23**10*022/6 ذره است. بنابراين در شرايط دما و فشار يكسان، يك مول از يك گاز حجمي برابر با يك مول از هر گاز ديگر اشغال ميكند. در شرايط متعارفي اين حجم، به حجم مولي گاز در شرايط متعارفي موسوم است و برابر با 414/22 ليتر ميباشد. - تعداد واحدها در يك مول به افتخار آمادئو آووگادرو ، عدد آووگادرو ناميده ميشود . وي نخستين كسي بود كه رفتار گازها را برحسب تعداد مولكولهاي واكنش دهنده توجيه كرد . درواقع آقاي آووگادرو خودش مقدار عددي اين عدد را نتوانست به دست آورد، اما چون وي رفتار گازها را بر حسب تعداد مولكولهاي واكنش دهنده را مورد بررسي قرار داد، بعدها كه اين عدد بدست آمد، به افتخار آووگادرو كه بنيان گذار اين كار بود، به نام وي نام گذاري نمودند. مقدار اين عدد با روشهاي الكترو شيميايي و بلور شناسي معين شده است . در روش بلور شناسي مثلا يك عنصر را در نظر ميگيرند سپس با دستگاههاي دقيق ساختار عنصر و طول هريك از اضلاع سلول واحد بلور و وزن اتمي عنصر و وزن حجمي آن را مشخص ميكنند . سپس به كمك يك عمليات رياضي ميتوان به عدد آووگادرو دست يافت به عنوان مثال نيكل در سيستم مكعبي با وجوه مركز پر متبلور ميشود . طول هر يك از اضلاع سلول واحد 52/3 آنگسترم ، وزن اتمي نيكل 7/58 و وزن حجمي آن 94/8 است .حال به كمك اين دادهها عدد آووگادرو را حساب ميكنيم : هر سلول واحد داراي چهار اتم نيكل است . اگر عدد آووگادرو را N در نظر بگيريم ، وزن هر اتم برابر( 7 /58 تقسيم بر N) گرم خواهد بود . وزن هر سلول واحد چهار برابر اين مقدار و حجم آن برابر( 52/3 ضرب در ده به توان منفي هشت ) كل اين مقدار به توان سه ، سانتيمتر مكعب است . حال اكر اين دو را تقسيم كنيم چگالي نيكل بدست ميآيد كه البته ضريبي است از Nبا توجه به اينكه ميدانيم چگالي نيكل برابر است با 94/8 پس با ميتوانيم مقدار N را كه همان عدد آووگادرو است حساب كرد . اگر بخواهيم از روش الكترو شيمي استفاده كنيم بايستي عدد فاراده را تقسيم بر بار يك الكترون تنها كنيم كه در اين صورت مقدار عدد آووگادرو حساب ميشود . كاربرد عدد آووگادرو براي بيان مفهوم اتم گرم شيميدانها جرم يك مول يا 6.023*10**23اتم را اتم گرم ميگويند و آنرا برحسب گرم بيان ميكنند. براي مثال اتم اكسيژن ، 16 گرم و اتم كربن ، 12 گرم است؛ يعني جرم يك مول از اتمهاي اكسيژن كه شامل 6.023*10**23اتم است، برابر 16 گرم و به همين ترتيب ، جرم يك مول از اتمهاي كربن برابر 12 گرم است. مفهوم مولكول گرم بديهي است جرم يك مول از مولكولهاي يك ماده كه «مولكول گرم» ناميده ميشود. به كمك اتم گرم اتمهاي سازنده آن به آساني قابل محاسبه است. براي مثال ، مولكول گرم اكسيژن O2 برابر مجموع دو اتم اكسيژن 16+16=32گرم و مولكول گرم CO2برابر است با مجموع دو اتم اكسيژن و يك اتم كربن 44=16+16+12 گرم است. مفهوم جرم مولكولي شمار اجزاي يك مول برابر با عدد آووگادرو است. تعداد مولكولهاي موجود در يك مول از يك تركيب مولكولي ، برابر با عدد آووگادرو است و جرم آن بر حسب گرم برابر با وزن مولكولي آن تركيب است. براي مثال ، وزن مولكولي H2Oبرابر با 18.02 است. در نتيجه داريم: 1mol H2O= 6.023*10**23 H2O مولكول چون يك مولكول آب داراي يك اتم O است يك مولكول H2Oشامل دو اتم از اتم H و يك مولكول از اتم O است
پیوندهای روزانه پيوندها
|
||||||||||||||||||||||||||||||||||||||||
|
|


 پس ...
پس ...